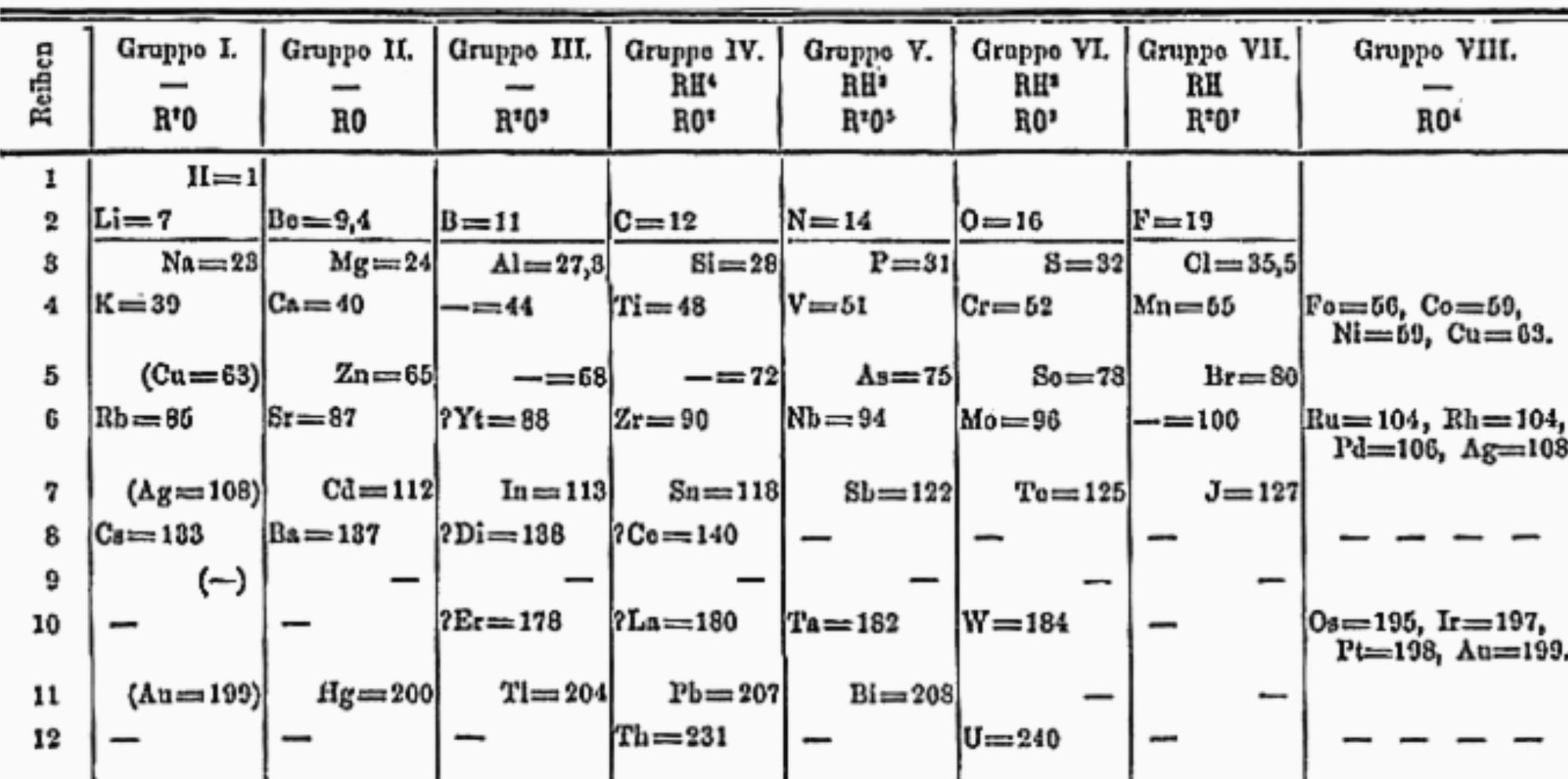
A quell'epoca erano noti più di 60 elementi chimici; al giorno d'oggi, il numero è pressoché duplicato (Figura 2). Gli ultimi 4 elementi (nihonio, moscovio, tennessinio e oganessio) sono stati presentati
ufficialmente nel 2016.
La tavola periodica include sia elementi stabili (cioè con tempo di vita infinito), sia elementi instabili (ossia elementi che nel tempo si trasformano in un elemento chimico diverso).
In natura si possono trovare tutti gli elementi, ad eccezione di quelli superpesanti, che sono creati artificialmente dall'uomo ed hanno tempi di vita estremamente brevi. Nella Tavola Periodica, gli elementi
sono ordinati per numero atomico crescente (indicato con il simbolo Z), ossia in base al numero crescente di “protoni” all’interno dei vari nuclei. Il protone è una delle particelle subatomiche fondamentali, avente massa pari a 1.7x10-24 gr
(circa 2000 miliardesimi di miliardesimi di miliardesimi di grammo) e carica positiva pari a 1.6x10-19 C (cioè 16 miliardesimi di miliardesimi di Coulomb, che è la quantità di carica elettrica trasportata in 1
secondo dal flusso di corrente di 1 Ampere). Gli atomi sono globalmente neutri, perché intorno ai nuclei (carichi positivamente) orbitano gli elettroni, che hanno carica negativa.
All’interno dei nuclei sono presenti anche i neutroni, ossia particelle con massa quasi uguale a quella dei protoni, ma senza carica. Un atomo è dunque costituito da un nucleo (contenente protoni e neutroni), immerso in una “nuvola”
di elettroni. La carica di un nucleo è indicata dal numero atomico (Z); la sua massa è invece solitamente
rappresentata dalla somma dei suoi nucleoni (A=protoni+neutroni: la massa degli elettroni è infatti trascurabile rispetto a quella dei nuclei).
Ogni elemento chimico ha una sua caratteristica “composizione isotopica”. Gli “isotopi”
sono atomi che hanno lo stesso numero atomico, ma un numero
diverso di neutroni. Esistono elementi che hanno un singolo isotopo stabile (come il fluoro o l’oro), elementi con molti isotopi
stabili (lo stagno, è quello che ne ha di più: ben 10!) ed elementi senza alcun isotopo stabile (come il tecnezio, che si trasforma in molibdeno).
Il lettore interessato può esplorare la Tavola Periodica degli Isotopi
pubblicata dallo IUPAC.
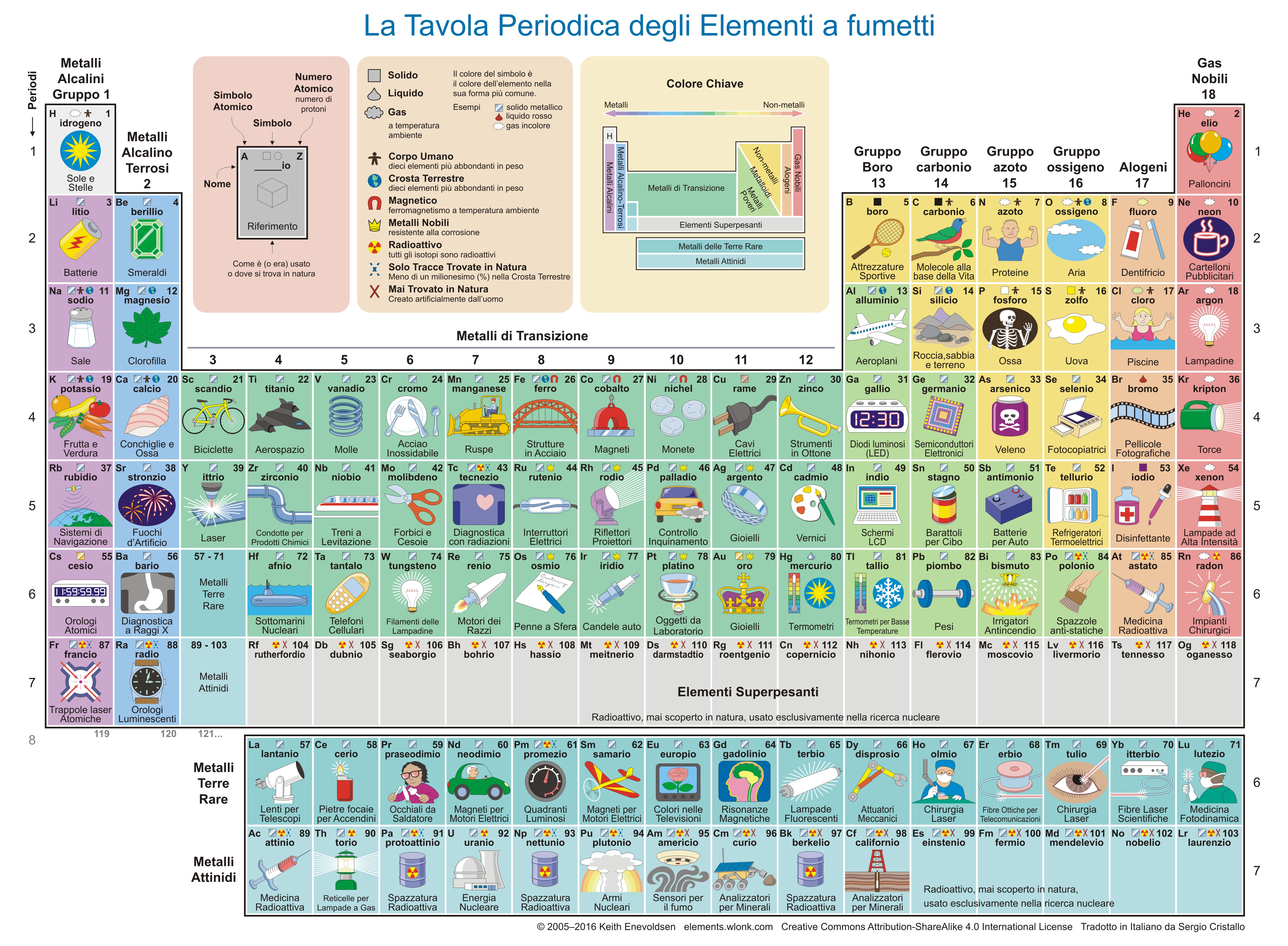
Scarica Figura 2 (pdf;jpg)