2019: ANNO INTERNAZIONALE DELLA TAVOLA PERIODICA
di Sergio Cristallo
La produzione degli elementi più pesanti dell'elio è decisamente più complessa, in quanto
non esistono nuclei stabili in natura aventi massa atomica A=5 ed A=8. Quindi non si può
immaginare di produrre elementi più pesanti attraverso semplici catture protoniche.
Nel 1951, prima Ernst Opik,
e poi in modo più dettagliato Edwin Salpeter (premio Craaford 1997), ipotizzarono che nelle stelle Giganti l’energia necessaria per controbilanciare la gravità provenisse dal bruciamento di 3 nuclei
di elio. Nel Sole questo tipo di reazione non può avvenire perchè il nucleo solare è troppo freddo e, di conseguenza, prevale la repulsione Coulombiana (è il principio secondo il quale particelle con carica uguale tendono a respingersi).
Il bruciamento dell'elio avviene in due fasi successive. Nella prima, due particelle α (un acronimo per indicare i nuclei di elio) si fondono in un nucleo di 8Be, il quale a sua volta cattura un’altra particella α, producendo 12C. Il problema connesso a questa teoria sta nel
tempo di vita del 8Be, che si ritrasforma in due particelle α in circa 2x10-16 secondi (ossia in un intervallo di tempo di 20 milionesimi di miliardesimo di secondo). La soluzione a questo problema fu proposta nel 1953
dal cosmologo inglese Fred Hoyle (premio Craaford 1997), che ipotizzò l’esistenza di un livello energetico risonante nella struttura atomica del 12C. Questo stato risonante fu confermato sperimentalmente in seguito nei
laboratori Kellogg del California Institute of Technology, dal gruppo di fisici nucleari guidato da William Fowler (Premio Nobel 1983). A questo livello è stato assegnato in passato l’epiteto di “livello della vita”,
perché l'esistenza del carbonio ha reso possibile lo sviluppo della vita, per come la conosciamo. La biologia umana, infatti, si basa sul ciclo del carbonio.
Una volta prodotto, tuttavia, il 12C può catturare a sua
volta un’altra particella α e produrre 16O. Compare dunque un nuovo isotopo/ elemento: l’ossigeno! Inutile soffermarsi sull’importanza dell’ossigeno
per noi (tanto per cadere nel banale, senza ossigeno non esisterebbe
l’acqua, la cui formula stechiometrica è H2O!!!). Nel Sole, dopo idrogeno ed elio, l’ossigeno è l’elemento chimico più abbondante (seguito a ruota dal carbonio; si veda Figura 3).
Nella crosta terrestre invece è
addirittura l’elemento più abbondante (si veda Figura 5): questo dimostra come la distribuzione degli elementi in un pianeta è profondamente diversa rispetto a quella delle stelle (e se guardassimo altri pianeti del Sistema
Solare, troveremmo ulteriori importanti differenze).
Figura 5: COMPOSIZIONI CHIMICHE A CONFRONTO
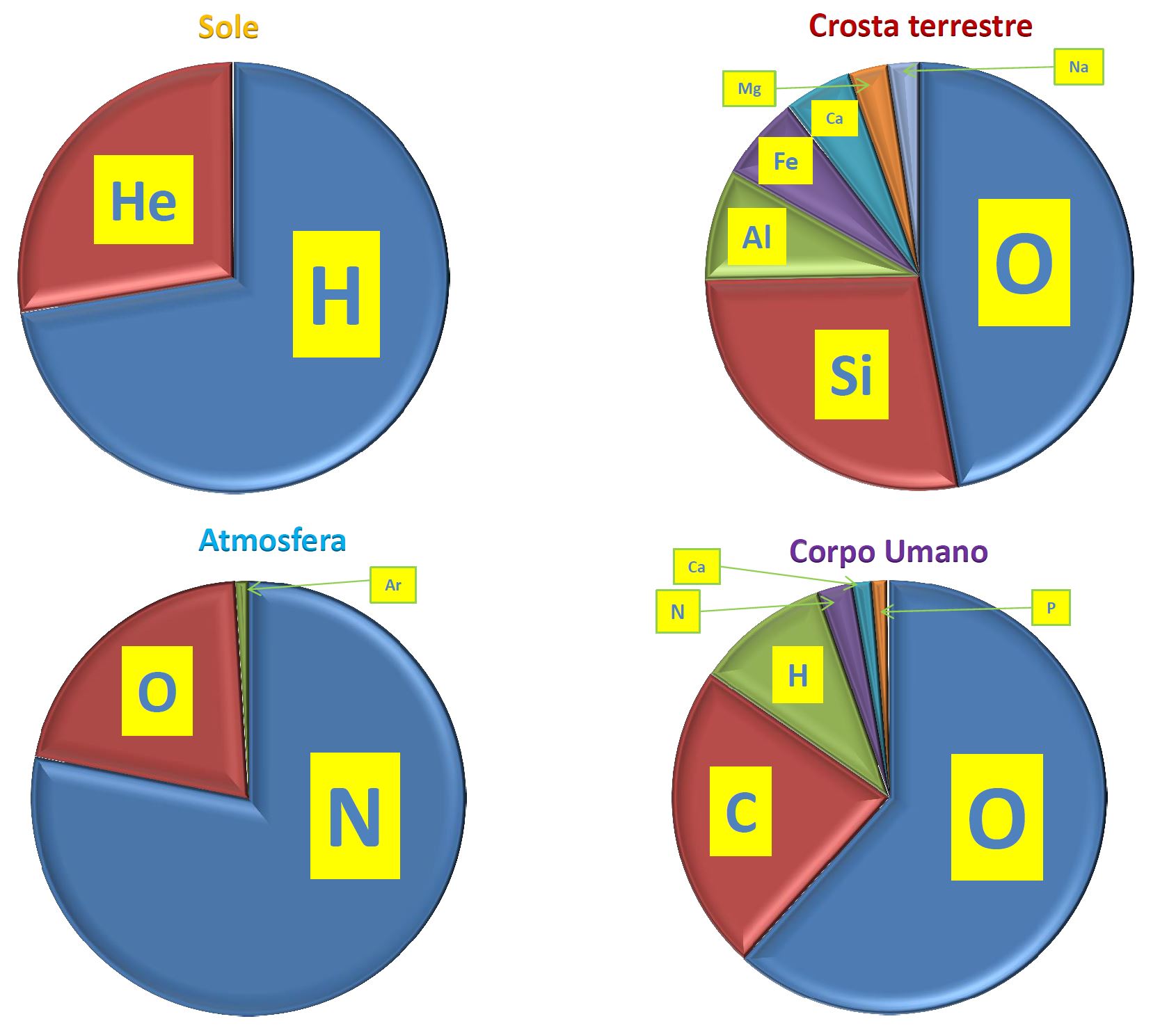
Come si può apprezzare da Figura 5, anche la composizione dell’atmosfera è profondamente diversa da quella della Crosta Terrestre. Nel primo caso, infatti, l’elemento
dominante è l’azoto. L'azoto si forma attraverso il cosiddetto “ciclo CNO”, ovvero un tipo di bruciamento dell’idrogeno alternativo a quello che avviene
nel Sole. Questo processo, studiato nel dettaglio da Hans Bethe (premio Nobel 1967), ha bisogno di una massa stellare leggermente più grande di quella del Sole per essere attivato in modo efficiente.
E ulteriormente diversa è la composizione del corpo umano, dove ossigeno, carbonio ed idrogeno sono i tre elementi dominanti (tutto
sommato non abbiamo bisogno di elementi così complessi per sopravvivere...anche se, come si suol dire, "il diavolo si nasconde nei dettagli"!).
E' piuttosto curioso pensare che, mentre i nostri corpi sopravvivono solitamente meno di un secolo, gli atomi
che li compongono (qualche miliardo di miliardo di miliardo) sono vecchi ALMENO 5 miliardi di anni!!!
